Анализ сердечно-сосудистых осложнений у пациентов с COVID-19
Содержание
Необходимость выявления ССЗ у пациентов с COVID-19
Методологические размышления
Клинические особенности и патофизиология
Распространенность ССЗ у пациентов с COVID-19
Сердечно-сосудистые осложнения у пациентов с коронавирусной инфекцией
Терапия COVID-19: медикаментозное взаимодействие и сердечно-сосудистые осложнения
Необходимость выявления ССЗ у пациентов с COVID-19
COVID-19 – это инфекция, которая несет значительные осложнения для сердечно-сосудистой системы пациентов. Это связано с некоторыми факторами. Например, имеющиеся в анамнезе сердечно-сосудистые заболевания (ССЗ) повышают риск тяжелого течения коронавирусной инфекции и смерти.
COVID-19 связывают со следующими сердечно-сосудистыми осложнениями, появление которых имеет прямые и косвенные доказательства действия инфекции:
- миокардит;
- острое повреждение миокарда;
- ВТЭ;
- аритмия.
Терапия, проводимая при лечении COVID-19 имеет побочные действия в форме сердечно-сосудистых заболеваний. Ответная реакция на коронавирус может подвергать риску быстроту сортировки больных без COVID-19, у которых уже имеются сердечно-сосудистые заболевания. Медицинские работники, оказывающие сердечно-сосудистую помощь, сами оказываются в уязвимом положении, так как подвергаются риску заболевания, либо становятся переносчиками.
Следовательно, необходимо тщательно изучать отчеты и исследования, относящиеся к анализу сердечно-сосудистых осложнений, связанных с COVID-19, так как это поможет быстрому решению вопросов у пациентов с ССЗ как в критическом состоянии, так и после него.
Методологические размышления
Большинство данных о пациентах с COVID-19 относятся к Китаю, так как эпицентр вспышки заболевания был именно в том регионе. Неоднократно предпринимались попытки анализа и систематизации данных из других стран, затронутых инфекцией. Однако информация, связанная с факторами риска ССЗ, была ограничена.
Необходимость такого анализа очевидна, так как стратегии тестирования, порог госпитализации и поведение при оказании медицинской помощи могут отличаться в разных условиях и влияют на оценку воздействия вируса. Эта разница в тестировании, уходе за больными, отчетности, ретроспективности и часто одноцентровых сериях, может влиять на оценку факторов риска в отчетах разных стран. В таких исследованиях, элементы данных которых обычно происходят из анализа диаграмм, не было контролируемых исследований, опубликованных докладов и внешнего перспективного подтверждения, что имеет важное значение при интерпретации результатов и определения приоритетов исследований.
Клинические особенности и патофизиология
Вирус SARS-COV-2, как и другие представители семейства Coronaviridae, — это оболочечный вирус с несегментированным одноцепочечным геномом с положительной цепью рибонуклеиновой кислоты (РНК).
Предположительно изначально исходным зоонозным переносчиком COVID-19 были летучие мыши, так как у них был обнаружен ряд коронавирусов, аналогичных SARS-COV-2, а его геном на 96,2% идентичен коронавирусу летучих мышей1.
Исследования показали, что рецептором и точкой входа в клетку SARS-COV-2 является Ангиотензинпревращающий фермент 2 (АПФ2). Этот интегральный мембранный белок I типа выполняет многие важные физиологические функции. Он широко представлен в альвеолярных клетках легких, обеспечивая основное место для проникновения вируса в организм человека. После связывания SARS-COV-2 проникает в клетки посредством рецепторно-опосредованного эндоцитоза, аналогично вирусу иммунодефицита человека. Так как АПФ2 защищает легкие, такое связывание способствует проникновению вируса в связи тем, что нарушает регуляцию защитного пути легких.
Возможные закономерности механизмов для АПФ2 в отношении вирусной патогенности и защиты легких и последствия от ингибирования ренин-ангиотензинальдостерона представлены на Рисунке 1.
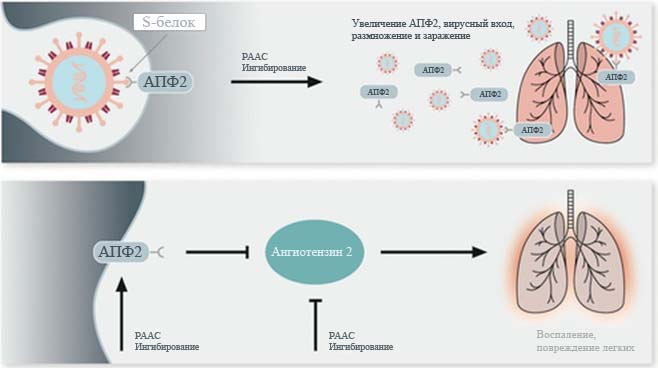
SARS-COV-2 связывается с АПФ2 через S-белок, облегчающий проникновение в клетку. Предполагается, что ингибирование РААС повышает активность АПФ2, чем увеличивает проникновение и репликацию вируса. Это можно увидеть на верхней части рисунка.
В свою очередь, АПФ2 снижает уровень ангиотензина 2, способствуя повреждению легких. Ингибиторы РААС могут потенциально повышать уровень АПФ2 и блокировать производство и функцию ангиотензина 2, тем самым косвенно ингибируя его (нижняя часть рисунка).
Общий коэффициент летальности от COVID-19, по данным университета Джона Хопкинса, по состоянию на март 2020 года составляет 3,8%, а заразность выше, чем у гриппа. Основная проблема вируса заключается в его высокой скорости распространения и большей заразности, что приводит к увеличению летальности.
Трудность установления показателей летальности связана с несколькими причинами:
- Бессимптомное или легкое течение заболевания, что приводит к дальнейшему распространению инфекции.
- Занижение диагностики вследствие адекватных возможностей тестирования в разных регионах, особенно с мало выраженными симптомами.
- Позднее наступление осложнений и смерти, через 2-3 недели после заражения.
Разнообразие симптоматики тоже вносит сложности со своевременной диагностикой. Так, клинические характеристики могут включать симптомы, которые присущи также и другим вирусным инфекциям — кашель, одышка, лихорадка, миалгия, диарея, усталость. В то же время могут проявляться и лабораторные аномалии, например, лимфопения.
Дети переносят заболевание легче и подвержены меньшим осложнениям, предположительно, по возможным причинам:
- Сильный врожденный иммунитет.
- Меньшее количество сопутствующих заболеваний.
- Различия в созревании вирусных рецепторов, предшествующее воздействие других видов коронавируса.
Поэтому определение прогностических факторов, которые помогут выявлять распространение COVID-19 и смертность, имеют очень важное значение, так как число заболевших постоянно растет.
Распространенность ССЗ у пациентов с COVID-19
В связи с различиями по странам в тестировании, отсутствия его массовости и стандартизированного сбора данных возникают сложности с оценкой распространенности ССЗ у пациентов с COVID-19. Анализ 6 исследований, состоящий из 1527 пациентов с коронавирусной инфекцией, выявил следующие показатели1:
- гипертония выявлялась у 17,1%, сердечные и цереброваскулярные заболевания у 16,4%, диабет — у 9,7%;
- общая летальность составляла 2,3% — это ниже, чем у пациентов с ССЗ (10,5%), диабетом (7,3%), гипертонией (6,0%).
Выяснилось, что механизмы, приводящие к сердечно-сосудистым заболеваниям, совпадают с механизмами, регулирующими иммунную функцию. Возраст, один из рисков восприимчивости и тяжести протекания COVID-19, является также фактором возникновения ССЗ. Например, у 50% людей старше 65-ти лет наблюдает снижение защитных титров при получении вакцины против гриппа. Таким образом, как нарушение регуляции иммунологического статуса повышает риск ССЗ, так и факторы ССЗ влияют на иммунную функцию.
Поэтому можно составить прогноз тяжести протекания COVID-19 с ССЗ. К примеру, существует предположение, что восприимчивость к SARS-CoV-2 увеличивается более высокой экспрессией АПФ2 у пациентов с артериальной гипертензией и ССЗ.
Сердечно-сосудистые осложнения у пациентов с коронавирусной инфекцией
Немногочисленные исследования подтверждают, что вирус SARS-CoV-2 как обостряет ранее существовавшие ССЗ, так и приводит к другим сердечно-сосудистым осложнениям. Это можно увидеть на Рисунке 2.
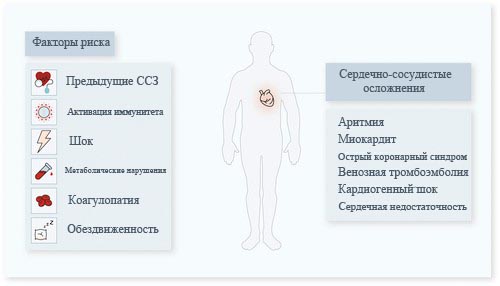
Повреждение миокарда, острые коронарные синдромы и миокардит
В случае тяжелого течения COVID-19 и гипоксии у некоторых пациентов может происходить повреждение миокарда, повышение уровня тропонина, вследствие ишемии миокарда или неишемических миокардиальных процессов, в том числе миокардит. В сыворотке наблюдались более высокий уровень тропонина у умерших пациентов с COVID-19, по сравнению с выжившими. Также уровень значительно повышен у пациентов с тяжелым течением, чем с нетяжелым.
Однако необходимо учитывать, что повышенный уровень тропонина может быть также у пациентов с запущенной почечной недостаточностью, вследствие замедленного выведения.
Возможна диагностика острого миокардита с помощью МРТ сердца при COVID-19. Наблюдения показывают, что из 68 смертей 7% были связаны с миокардитом с недостаточностью кровообращения, а 33% — это случаи, когда миокардит мог сыграть решающую роль в смерти пациента. Статистически значимых данных о связи COVID-19 и острого коронарного синдрома на данное время нет. Однако же существует высокая вероятность, в случае тяжелого течения заболевания, у восприимчивых пациентов выраженного воспалительного ответа, гемодинамических изменений и риска разрыва атеросклеротической бляшки.
Аритмия и остановка сердца
Очень часто пациенты с коронавирусной инфекцией жалуются на появление аритмии. В наблюдениях из 137 пациентов у 7% было учащенное сердцебиение, а аритмия отмечена у 16,7% госпитализированных, находящихся в ОИТ. Распространенность аритмий частично может быть связана с гипоксией, нарушением обмена веществ, воспалительным или нейрогормональным стрессом.
Необходимо обратить внимание на возникновение злокачественных тахиаритмий на фоне повышения тропонина. Это может говорить о развитии миокардита.
Сердечная недостаточность и кардиомиопатия
Сердечная недостаточность больше распространена у пациентов с летальным исходом, чем у тех, которые выжили — 51,5% против 11,7%, и наблюдалась у 23%.
Кардиогенный и смешанный шок
Необходимо учитывать кардиогенные или смешанные сердечные и первичные легочные причины ОРДС коронавирусной инфекции. Возможно использовать берлинские критерии для выявления пациентов с ОРДС —отсутствие перегрузки объемом и визуализация с двусторонним затемнением легких. Для уточнения диагноза можно использовать эхокардиографию и сыворотку натрийуретического пептида ГМ. При недостаточной эффективности данных методов, сохранении проблемы смешанной картины, возможно использование катетеризации легочной артерии. Это поможет оценить давление наполнения и сердечный выброс. Также возможно использование ЭКМО при принятии решения о механической поддержке дыхания и кровообращения.
Венозная тромбоэмболия
Частота проявлений венозной тромбоэмболии у тяжелых пациентов с COVID-19 может достигать 31%. Это связано с ненормальными параметрами свертывания крови при тяжелом течении. Также высокий уровень смертности наблюдается при повышенном уровне D-димера и продуктов распада фибрина.
Дополнительным фактором риска является длительная иммобилизация пациента. Гипоксия или гемодинамическая нестабильность при ухудшении клинической картины может свидетельствовать о тромбоэмболии. Введение профилактической дозы низкомолекулярного гепарина на фоне коагулопатии доказало свою эффективность для снижения смертности, однако до сих пор не выработан оптимальный режим профилактики тромбоэмболии у пациентов с COVID-19. У госпитализированных пациентов в острой форме предпочтительно использование пероральных антикоагулянтов, гепарина в сочетании с механической профилактикой или без нее.
Терапия COVID-19: медикаментозное взаимодействие и сердечно-сосудистые осложнения
В каждой стране оказывают противодействие коронавирусной инфекции исходя из своих стратегий лечения. Ниже приведены таблицы, которые объединяют результаты данных о противовирусной терапии с препаратами для лечения ССЗ.
Таблица 1. Взаимодействие противовирусных препаратов и сердечно-сосудистой системы
| Противовирусная терапия | Механизм действия | Класс сердечно-сосудистых препаратов | Побочные эффекты со стороны сердечно-сосудистой системы |
| Ремдесивир | Нуклеотидный аналог ингибитора РНК-зависимых РНК-полимераз | Н/д | Неизвестно |
| Рибавирин | Подавляет репликацию РНК и ДНК вирусов | Антикоагулянты | Необходимо избегать пациентам со значительным или нестабильным сердечным заболеванием. Гемолитическая анемия, вызванная лекарственными препаратами |
| Лопинавир, ритонавир | Ритонавир повышает уровень лопинавира, подавляя метоболизм CYP3A. Лопинавир — ингибитор протеазы. | Антиагреганты, антикоагулянты, статины, антиаритмические средства | Нарушение сердечной проводимости: удлинение интервала QTс, атриовентрикулярная блокада, «скручивание пиков», повышение уровня холестерина в сыворотке |
Таблица 2. Сердечно-сосудистые взаимодействия и другие методы лечения COVID-19
| Терапия | Механизм действия | Класс сердечно-сосудистых препаратов | Побочные эффекты со стороны сердечно-сосудистой системы |
| Анакинра | Блокирует IL-1α и IL-1β. Гиперпродукция IL-1β связана с патогенезом синдрома активации макрофагов. | Нет | Нет |
| Бевацизумаб | Подавляет возможный повышенный фактор роста эпителия сосудов у пациентов с COVID-19, снижает проницаемость сосудов и отек легких | Нет | Прямая миокардиальная токсичность в сравнении с обострением основной кардиомиопатии. Тяжелая гипертензия. Тромбоэмболические события. |
| Хлорохин, гидроксихлорохин | Изменяет эндосомный pH, необходимый для слияния вируса и клетки, и препятствует гликозилированию клеточных рецепторов SARS-CoV-2. | Антиаритмические препараты | Прямая миокардиальная токсичность по сравнению с обострением лежащей в основе кардиомиопатии. Нарушение сердечной проводимости: атриовентрикулярная блокада, удлинение интервала QT, «скручивание пиков», желудочковая тахикардия/фибрилляция. |
| Колхицин | Противовоспалительные свойства потенциально ингибируют патогенетический цикл SARS-COV-2 за счет противодействия сборке инфламмасомы NLRP3 и, что менее вероятно, ингибирования вирусного эндоцитоза в миокардиальных и респираторных клетках. | Блокаторы кальциевых каналов, статины, антиаритмические средства | Нет |
| Экулизумаб | Подавляет активацию комплемента и предотвращает образование комплекса атаки на мембрану. | Нет | Гипертония или гипотония, тахикардия, периферические отеки. |
| Финголимод | Подавляет лимфоциты за счет регуляции сфингозин-1-фосфата. | Антиаритмические препараты | Гипертония, АВ-блокада первой и второй степени (противопоказана при АВ-блокаде высокой степени и синдроме слабости синусового узла), брадикардия, удлинение QTc (противопоказано, если QTc≥500 мс). Противопоказан после инфаркта миокарда, нестабильной стенокардии, нарушении мозгового кровообращения и переходящей ишемической атаке, СДВГ в предыдущие 6 месяцев. |
| Интерферон-альфа, бета | Иммунная активация | Варфарин | Прямая миокардиальная токсичность в сравнении с обострением основной кардиомиопатии. Сообщения о гипотензии, аритмии, кардиомиопатии, инфаркте миокарда |
| Пирфенидон | Антифиброзная способность, возможное ингибирование IL-1β и IL-4 для уменьшения цитокинового шторма и, как следствие, легочного фиброза. | Нет | Нет |
| Метилпреднизолон | Изменяет экспрессию генов, чтобы уменьшить воспаление. | Варфарин | Задержка жидкости. Электролитные нарушения. Гипертония. |
| Сарилумаб | Связывается как с растворимыми, так и с мембраносвязанными IL-6R и подавляет передачу сигналов, что может помочь смягчить цитокиновый шторм. | Антиагреганты. Антикоагулянты. Статины. Антиаритмические средства. | Н/д |
| Тоцилизумаб | Подавляет рецептор IL-6. | Антиагреганты. Антикоагулянты. Статины. Бета-блокаторы эволокумаба. Антиаритмические препараты. | Гипертония. Повышенный холестерин. |
| Транексамовая кислота | Снижение превращения плазминогена в плазмин потенциально может снизить инфекционность и вирулентность вируса. | Нет | Сообщалось о венозном и артериальном тромбозе и тромбоэмболии, включая обструкцию артерии или вены сетчатки. Соблюдайте осторожность у пациентов с неизлечимыми сердечно-сосудистыми или цереброваскулярными заболеваниями из-за осложнений тромбоза. |
Для смягчения побочных эффектов медикаментов при лечении пациентов с ССЗ и профилактики осложнений рекомендуется соответственно проводить корректировку лекарственного взаимодействия.
Таблица 3. Дозировка и корректировка лекарственного взаимодействия.
| Терапия | Взаимодействие | Механизм взаимодействия с лекарствами и корректировки конкретных доз | Примечания |
| Хлорохин, гидроксихлорохин | Бета-блокаторы:
|
Ингибирование CYP2D6:
|
— |
|---|---|---|---|
Антиаритмические средства:
|
Интенсивное удлинение QTc | Контроль ЭКГ | |
|
Ингибирование P-гликопротеина:
|
Контроль уровня дигоксина | |
| Колхицин | Блокатор кальциевых каналов:
|
Ингибирование CYP3A4 и Р-гликопротеина, индуцированное CCB
|
Контролировать появление признаков токсичности колхицина. |
Статины:
|
Возможное ингибирование или нарушение выведения CYP3A4:
|
Контроль за признаками мышечной боли и/или слабости при сопутствующей терапии | |
Антиаритмические средства
|
Ингибирование P-гликопротеина:
|
Контроль уровня дигоксина | |
| Финголимод | Лекарства, вызывающие брадикардию
|
Ингибирование сфингозин-1-фосфата на миоциты предсердий может снизить AВ-проводимость; если необходимо совместное введение, рекомендуется непрерывный мониторинг ЭКГ в течение ночи после первой дозы | Если возможно, прекратить прием препаратов, блокирующих АВ-узел. |
Антиаритмические средства, удлиняющие интервал QT
|
Не применять одновременно | Контроль ЭКГ | |
| Интерферон-альфа, бета | Варфарин | Неизвестный механизм действия:
|
Контроль МНО |
| Ремдесивир | Н/д | Возможный индуктор CYP1A2, CYP2B6 и CYP3A4. Коррекция дозы не рекомендуется | Н/д |
| Рибавирин | Антикоагулянты
|
Неизвестный механизм действия:
|
Контроль МНО |
| Сарилумаб | Антикоагулянты
|
Повышенная экспрессия CYP3A4:
|
Контроль МНО. Контроль ЭКГ |
| Тоцилизумаб | Антикоагулянты
|
Повышенная экспрессия CYP3A4:
|
Контроль МНО. Контроль ЭКГ |
1 Cardiovascular Considerations for Patients, Health Care Workers, and Health Systems During the COVID-19 Pandemic//Journal of the American College Cardiology, 75, 2020 May